Ce site utilise des cookies afin que nous puissions vous fournir la meilleure expérience utilisateur possible. Les informations sur les cookies sont stockées dans votre navigateur et remplissent des fonctions telles que vous reconnaître lorsque vous revenez sur notre site Web et aider notre équipe à comprendre les sections du site que vous trouvez les plus intéressantes et utiles.
|
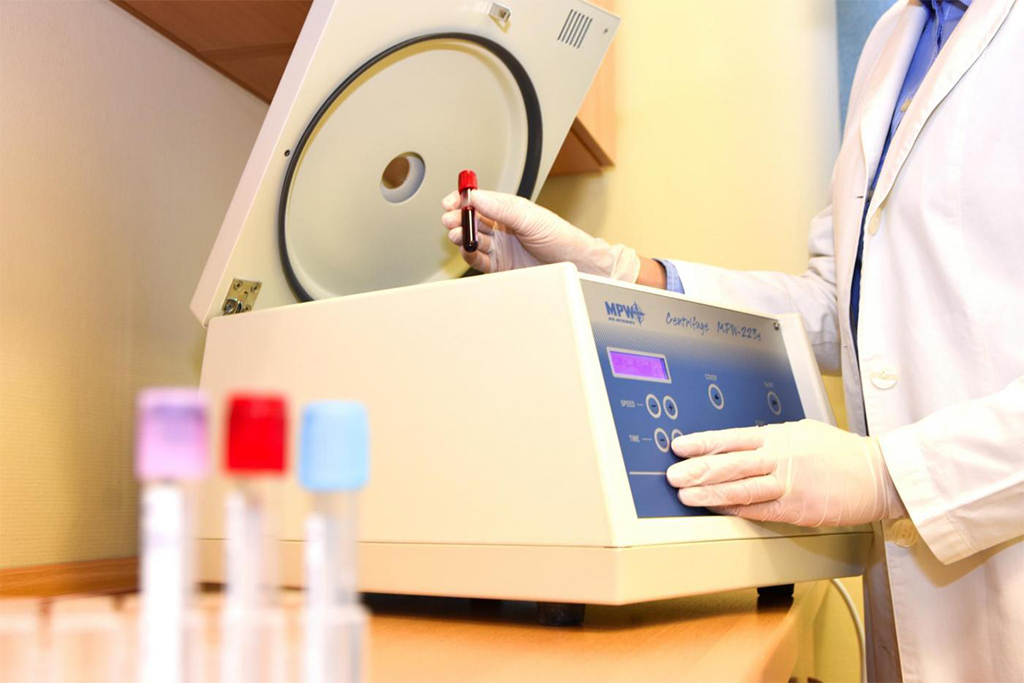
QU’EST-CE QU’UN ESSAI CLINIQUE? Un essai clinique est un programme de recherche avec la participation de patients (participants à l’étude), dans lequel la sécurité d’utilisation et l’efficacité d’une substance médicamenteuse/dispositif médical donné sont vérifiées. Chaque nouvelle substance ou technologie est soumise à des tests très détaillés et rigoureux avant d’être enregistrée et mise sur le marché. Par conséquent, les patients qui participent à un essai clinique sont régulièrement suivis par le personnel médical pour signaler leur état de santé. Les écarts possibles par rapport à la norme sont donc également inclus dans les dossiers médicaux du participant au test. Sur la base de l’analyse des résultats obtenus au cours de l’essai clinique, il peut donc être conclu si le produit répond aux exigences de sécurité et d’efficacité, ce qui donne la base de la possibilité de le mettre sur le marché. |
 |
 |
QUELS SONT LES AVANTAGES DE PARTICIPER À UN ESSAI CLINIQUE?
|
|
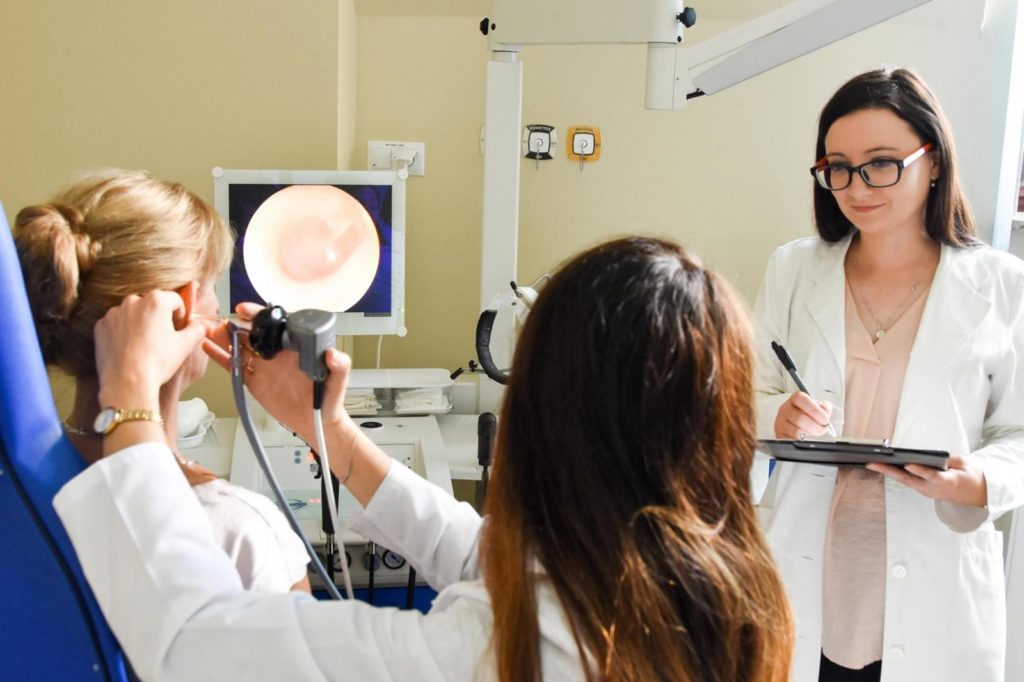
QUI PEUT PARTICIPER À L’ESSAI CLINIQUE? Les informations sur les personnes pouvant participer à l’étude sont contenues dans le protocole de l’étude clinique. Les critères dits d’inclusion et d’exclusion. La question de savoir si une personne est qualifiée pour une étude particulière et peut donc y participer est décidée par un médecin qui est appelé chercheur dans la nomenclature des essais cliniques. Il est également tenu d’informer toute personne consentante des bénéfices et risques potentiels d’une étude donnée, ainsi que de répondre aux questions des patients. |
 |
 |
QUELLES SONT LES OBLIGATIONS DU PATIENT PARTICIPANT À L’ÉTUDE? La signature du patient d’un consentement à participer à l’étude l’oblige à se conformer aux directives applicables à l’essai clinique concerné. Selon les études, les obligations des patients peuvent être différentes. Les tâches les plus courantes du participant consistent à prendre le médicament tel que prescrit, à subir des visites de suivi, à signaler des symptômes dérangeants, à tenir un journal de contrôle de paramètres spécifiques, à remplir des questionnaires concernant l’état de santé, etc. Cependant, à tout moment pendant l’essai clinique, le participant peut être retiré de toute participation ultérieure. |
TESTS RÉALISÉS OU EN COURS DE RÉALISATION
- Polypes du nez – recrutement en cours
- Maladie de meniere – le recrutement est terminé
- Nncn – déficience auditive sensio-nerveuse soudaine – le recrutement est terminé
- Polypes du nez – le recrutement est terminé
- Vertiges – le recrutement est terminé
- Tinning – le recrutement est terminé
Si vous êtes intéressé par l’une de nos recherches, veuillez nous contacter:
badania.kliniczne@medincus.pl
mgr Iwona Tomaszewska-Hert
tél: +48 22 46 35 342
|
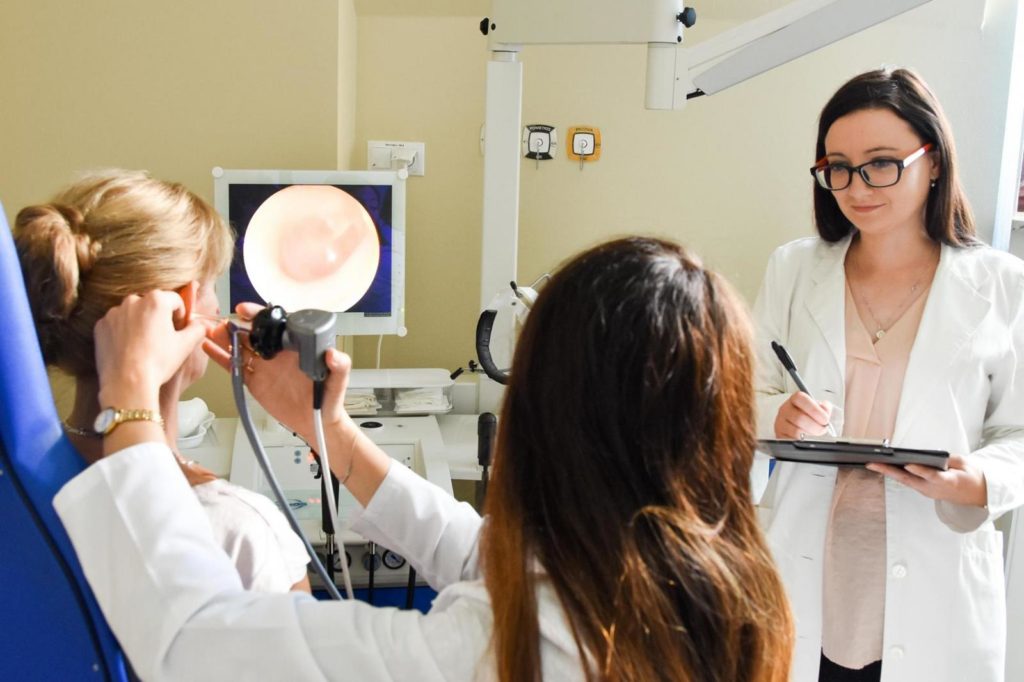
Forts de notre expérience et du potentiel d’une entité médicale spécialisée telle que le Centre de l’Audition et de la Parole MEDINCUS, nous souhaitons participer activement au développement de la médecine et ainsi élever les standards de traitement. Ceci est possible grâce à la possibilité d’améliorer la santé des patients participant à des études individuelles et, par conséquent, également de l’ensemble de la population aux prises avec la maladie. |
 |
OFFRE DE COOPÉRATION DANS LA CONDUITE D’ESSAIS CLINIQUES
Nous vous invitons à coopérer avec notre équipe! Contactez-nous:
badania.kliniczne@csim.pl
mgr Iwona Tomaszewska-Hert
tél: +48 22 46 35 342

|
Kajetany, 7, rue Mokra, 05-830 Nadarzyn Iwona Tomaszewska-Hert tél: +48 22 46 35 342
|









